2024年4月17日��,中國蘇州——復融生物����,一家致力于“攻克人類重大疾病”的生物科技公司�����,今日宣布����,其自主研發(fā)�����、擁有全球知識產(chǎn)權(quán)的創(chuàng)新生物藥白介素15(IL-15)超級免疫激動劑FL115注射液FL115的第二個適應癥用于“非肌層浸潤性膀胱癌(NMIBC)”的I/II期臨床申請獲得國家藥品監(jiān)督管理局藥品審評中心(CDE)的正式受理�。
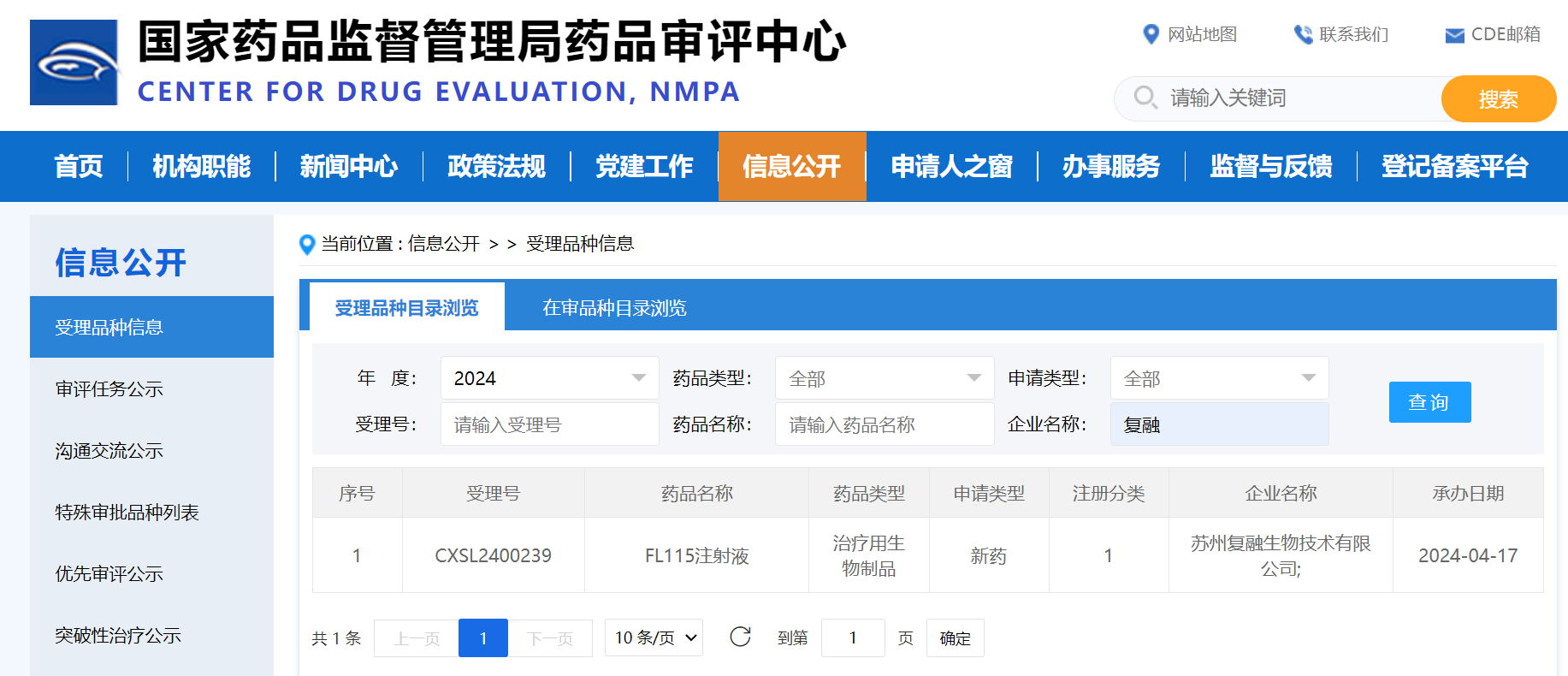
在此之前,F(xiàn)L115首個IND申請��,應用于“不可切除局部晚期或轉(zhuǎn)移性實體瘤”于2024年3月4號獲CDE臨床默示許可����,由中山大學腫瘤防治中心張力教授牽頭的I期研究即將正式開始。同期在美國開展的I期試驗已完成多例受試者入組��。
膀胱癌是泌尿系統(tǒng)最常見的惡性腫瘤之一,在全世界范圍內(nèi)���,膀胱癌發(fā)病率居惡性腫瘤的第9位�,死亡率居第13位���,在中國范圍內(nèi)�����,根據(jù)2024年全國腫瘤登記中心發(fā)布的數(shù)據(jù):2022年我國新發(fā)膀胱癌總數(shù)達9.29萬��,發(fā)病率為3.44/10萬����,位居惡性腫瘤第11位���,死亡總數(shù)達4.14萬�����,發(fā)病率1.34/10萬��,位居第13位���。根據(jù)腫瘤是否進入膀胱肌層��,分成非肌層浸潤性膀胱癌(NMIBC)和肌層浸潤性膀胱癌(MIBC)�����,其中NMIBC約占膀胱癌的75%��。根據(jù)復發(fā)風險及預后的不同����,NMIBC分成低危��、中危����、高危和極高危,對于高危和極高?�;颊吲R床推薦卡介苗(BCG)灌注�����,盡管BCG膀胱灌注可以降低膀胱癌的復發(fā)率并減少進展���,但仍有40%患者對治療無反應�����,60%患者在治療1年內(nèi)復發(fā)����,BCG治療失敗或無應答患者目前國內(nèi)外指南推薦優(yōu)選根治性膀胱切除術���,但因術后高復發(fā)率和死亡風險以及術后給患者生活質(zhì)量造成的負面影響��,使得很多患者拒絕手術或不適合手術�����,對于這些患者臨床上存在極大未滿足需求�����。
IL-15是一種參與各種免疫反應的細胞因子��,可特異性結(jié)合在CD8+T細胞和NK細胞上的IL-2Rα/IL-15Rβ-γc受體�,刺激CD8+T細胞和NK細胞增殖和生存,預估可因此增強在BCG治療失敗患者中的免疫作用�����,同類產(chǎn)品由美國Immunity Bio公司開發(fā)的ALT-803已證明在BCG治療失敗NMIBC患者中的良好療效和安全性��。FL115作為下一代創(chuàng)新的IL-15激動劑�����,其在NMIBC患者中的效果值得期待�!
復融生物聯(lián)合創(chuàng)始人、董事長紀恩表示:“我們非常高興看到FL115的第二個適應癥IND獲得CDE正式受理����,這標志著FL115臨床研究和治療方案開發(fā)的另一個重要里程碑。我們相信復融生物在攻克人類重大疾病的愿景驅(qū)動下���,基于對合成免疫學的深刻理解�����,將會開發(fā)出更多����、更好的生物創(chuàng)新藥,以滿足人民對健康生活的需求����,對美好生活的向往����。”
IL-15是一種多效性細胞因子����,可以和細胞上IL-15Rα亞基結(jié)合,具有激活T細胞���、B細胞和NK細胞���,并可介導這些細胞的增殖和存活的功能。
FL115是一種可溶性sFc融合蛋白�����,克服了重組IL-15半衰期短����、生物活性低和治療窗口窄的缺點��,且分子量小�����,實體瘤穿透能力強�,安全性極高��,生產(chǎn)工藝簡單穩(wěn)健��,具有更低的生產(chǎn)成本��。臨床前研究發(fā)現(xiàn)��,F(xiàn)L115在體內(nèi)能夠更好的促進NK細胞在腫瘤局部顯著富集�����,是一款NK細胞主導的抗腫瘤免疫激活劑�����。
復融生物是一家以合成免疫學為技術驅(qū)動���、聚焦細胞因子等蛋白藥物開發(fā)的創(chuàng)新型研發(fā)企業(yè)�。公司背靠國際知名蛋白藥物發(fā)現(xiàn)實驗室,創(chuàng)始團隊具備深厚的科研轉(zhuǎn)化能力����,核心團隊深耕創(chuàng)新藥開發(fā)數(shù)十年��,具有豐富的產(chǎn)業(yè)化經(jīng)驗�����。復融生物在攻克人類重大疾病的使命召喚下����,致力于成為基于合成免疫的細胞因子藥物領軍企業(yè),在以患者為中心���、勇于創(chuàng)新�����、追求卓越�、誠信道德�����,團隊精神的價值觀引領下,相信在不久的未來將造福更多的癌癥患者�����。公司擁有獨創(chuàng)的Fbody?長效化藥物平臺���、Syntokine?人工合成細胞因子平臺等��,基于技術平臺的首款腫瘤免疫激動劑FL115目前正在中美兩地開展I期臨床試驗�。
企業(yè)使命:攻克人類重大疾病
企業(yè)愿景:致力于成為基于合成免疫的細胞因子藥物領軍企業(yè)
企業(yè)價值觀:以患者為中心����、勇于創(chuàng)新、追求卓越���、誠信道德��、團隊精神