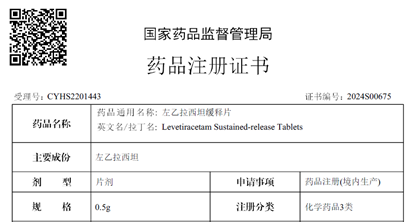
近日�����,越洋醫(yī)藥自主研發(fā)的左乙拉西坦緩釋片(500mg)獲得國家藥品監(jiān)督管理局(NMPA)上市批準(zhǔn)�,批準(zhǔn)文號:國藥準(zhǔn)字H20243583,該產(chǎn)品為《國家基本醫(yī)療保險��、工傷保險和生育保險藥品目錄》醫(yī)保乙類產(chǎn)品����。左乙拉西坦作為多國指南推薦的抗癲癇優(yōu)選藥物,可用于癲癇的單獨治療����,其緩釋制劑為每日一次服藥,避免了因普通制劑血藥濃度波動而引起的癲癇發(fā)作風(fēng)險����。此規(guī)格的獲批標(biāo)志著中美雙報雙獲批圓滿收官。2022年左乙拉西坦全球銷售額超25億美元��,中國銷售額近10億元�,中國院內(nèi)銷售額增長達(dá)13%左右��。目前此產(chǎn)品正在尋找中國和其他國家的商業(yè)化合作伙伴。
公司召開了產(chǎn)品獲批慶功會��,會上項目組成員紛紛發(fā)表了獲獎感言���,表達(dá)對公司的祝賀和感激�����。公司首席技術(shù)官范軍博士發(fā)言講述了產(chǎn)品從研發(fā)�、生產(chǎn)��、臨床到注冊申報���、FDA現(xiàn)場核查及缺陷信答復(fù)的種種挑戰(zhàn)�����,獲批是起點也是公司轉(zhuǎn)型商業(yè)化的開始��,這是大家齊心協(xié)力�、團結(jié)一致的結(jié)果����。最后,越洋創(chuàng)始人、董事長兼CEO聞曉光博士表達(dá)了對全體越洋人的感謝�����,強調(diào)雖然實現(xiàn)了中美雙報雙獲批“零”的突破�,但這只是萬里長征邁出的第一步,強調(diào)越洋人要繼續(xù)秉承只為成功找出路不為失敗找借口的工作理念����,不忘初心,真正把緩控釋新藥在中美等多國獲批上市���,做到越洋銷售全球�����,給患者帶來療效更優(yōu)���、副作用更小、順應(yīng)性更好的新藥�����,這樣公司才能做得更好���、走得更遠(yuǎn)����。



2011年12月成立�,廣州,江蘇泰州和美國加州圣地亞哥擁有研發(fā)及中試放大基地���,擁有多名全職歐美海歸及本土骨干人才�����,擁有100+名員工及10000多平方米基地�。20+新藥獲批中美臨床批件��,10+新藥處于I期和III期臨床階段�����,一個緩控釋產(chǎn)品在中國和美國獲批上市許可���。
主營業(yè)務(wù)
—上市許可持有人
應(yīng)用越洋專有和通用緩控釋技術(shù)開發(fā)針對美國市場的NDA(505(b)(2))申報路徑)和中國市場的2類新藥�;委托生產(chǎn)����,委托銷售����。
—產(chǎn)品開發(fā)技術(shù)服務(wù)
借助公司的專有平臺技術(shù)(UC-trol?, Mech-trol?, Bi-lock?)以及通用平臺技術(shù)(Multi-layer, Tablet-in-tablet, Osmotic Pump)服務(wù)客戶�,1)提高NCE的成藥性;2)把客戶的一代普通制劑進行迭代創(chuàng)新轉(zhuǎn)化成緩控釋新藥����,延長產(chǎn)品壽命,3)為國內(nèi)外客戶開發(fā)緩控釋仿制藥����。
—產(chǎn)品共同開發(fā)
希望與值得信賴的合作伙伴共同開發(fā)已進入不同臨床研究階段的緩控釋新藥產(chǎn)品;聯(lián)合開發(fā)在中美已獲得臨床試驗許可的緩控釋新藥產(chǎn)品����。公司產(chǎn)品涉及疼痛、失眠��、癲癇���、抑郁癥�����、高血壓��、糖尿病�����、類風(fēng)濕性關(guān)節(jié)炎等多個適應(yīng)證領(lǐng)域�。
—產(chǎn)品權(quán)益轉(zhuǎn)讓
國內(nèi)外獲批的臨床批件��,不同臨床階段的產(chǎn)品及生產(chǎn)批件轉(zhuǎn)讓給國內(nèi)外藥企����,越洋醫(yī)藥獲得轉(zhuǎn)讓費和銷售提成。