2025年6月����,蘇州予路乾行生物科技有限公司(Divamics Inc.)攜手武漢理工大學(xué)再次在Journal of Chemical Information and Modeling(JCIM)國(guó)際頂刊上發(fā)表了最新的研究成果《Accommodating Statistical and Physics-Based Computational Protocols for Molecular Glue Model and Evaluation》,該論文由徐戚軒工程師��,劉文朗工程師���,劉昊博士�����,鄭錚博士共同撰寫���。

本篇文章展示了予路乾行利用AI+分子動(dòng)力學(xué)在分子膠領(lǐng)域的又一學(xué)術(shù)突破���,這項(xiàng)研究不僅為“分子膠”的理性設(shè)計(jì)提供了系統(tǒng)性的計(jì)算框架,也為未來(lái)靶向蛋白-蛋白相互作用(PPIs)的創(chuàng)新藥物開(kāi)發(fā)奠定了堅(jiān)實(shí)基礎(chǔ)�����。
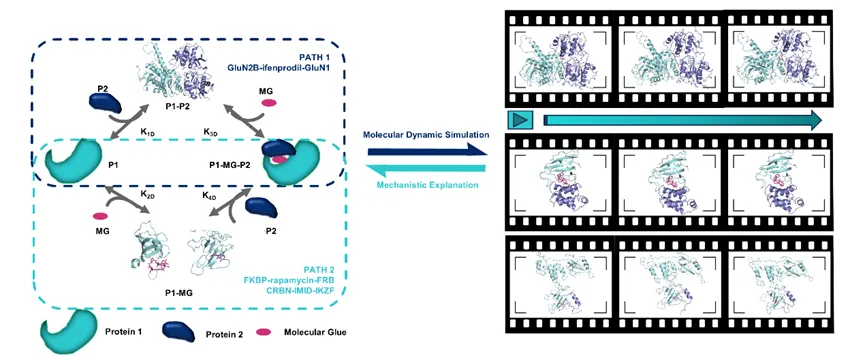
AI+分子動(dòng)力學(xué)研究分子膠體系
01 什么是“分子膠”�����?
“分子膠”是一類能夠誘導(dǎo)或穩(wěn)定蛋白質(zhì)之間相互作用的小分子化合物�。與傳統(tǒng)抑制劑不同�����,“分子膠”并非直接阻斷蛋白功能�,而是像“膠水”一樣將兩個(gè)蛋白“粘合”�,從而調(diào)控細(xì)胞信號(hào)通路,實(shí)現(xiàn)疾病干預(yù)�。

分子膠與蛋白結(jié)合示意圖
這類藥物在腫瘤、神經(jīng)退行性疾病�、免疫調(diào)節(jié)等領(lǐng)域展現(xiàn)出巨大潛力,但其設(shè)計(jì)難度極高——不僅要識(shí)別復(fù)雜的蛋白結(jié)合界面�����,還需預(yù)測(cè)小分子如何介導(dǎo)這種動(dòng)態(tài)互作過(guò)程��。
據(jù)不完全統(tǒng)計(jì)�����,近兩年��,分子膠領(lǐng)域已產(chǎn)生十幾筆交易�,總金額超過(guò)130億美元,這一數(shù)據(jù)足以證明其市場(chǎng)潛力�����。
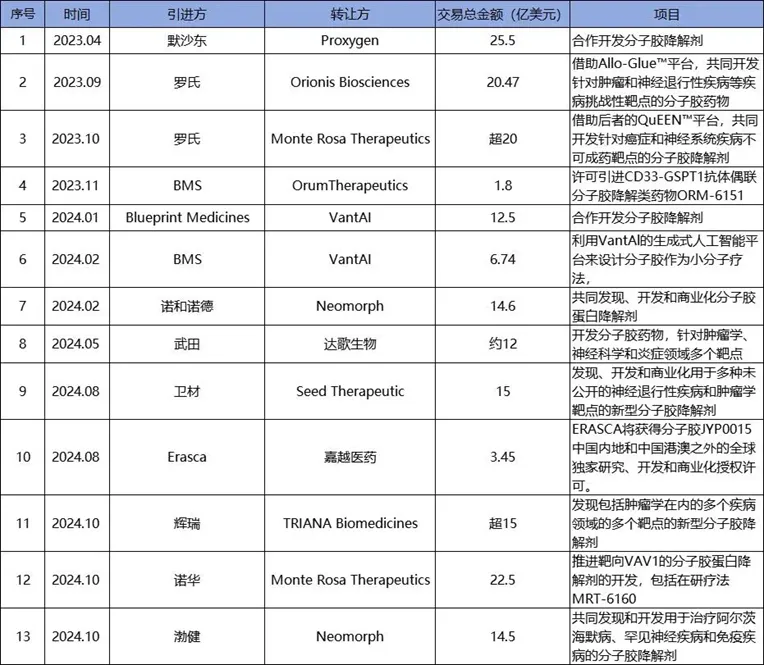
2023年以來(lái)分子膠領(lǐng)域的交易并購(gòu)盤點(diǎn)
(圖源:公開(kāi)數(shù)據(jù)整理����,貝殼社)
02 研究亮點(diǎn):AI+物理建模雙劍合鞘
過(guò)去對(duì)“分子膠”的研究多依賴于高分辨率結(jié)構(gòu)技術(shù)(如冷凍電鏡),但這些方法成本高昂�、周期長(zhǎng),難以大規(guī)模應(yīng)用����。
本研究的最大創(chuàng)新在于構(gòu)建了兩種計(jì)算模型,分別適用于兩類不同的“分子膠”作用機(jī)制:
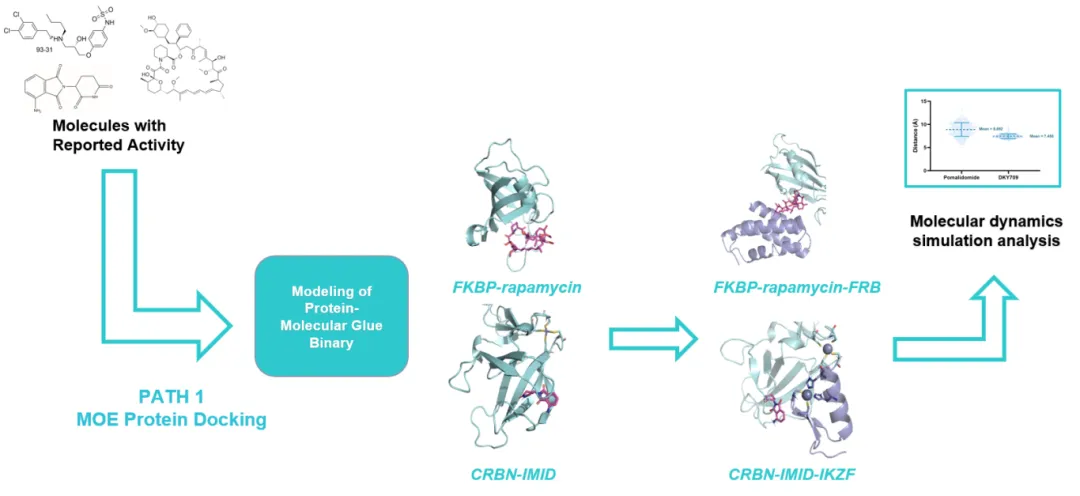
路徑一:兩個(gè)蛋白天然無(wú)法形成復(fù)合物��,通過(guò)引入分子膠����,可以形成全新的蛋白-蛋白結(jié)合界面
適用于需要“誘導(dǎo)性結(jié)合”的“分子膠”。利用已知結(jié)合位點(diǎn)作為錨點(diǎn)���,模擬小分子引導(dǎo)蛋白間互作界面的形成��。
路徑二:兩個(gè)蛋白天然已有界面����,通過(guò)引入分子膠,可以讓界面結(jié)合更穩(wěn)定
適合那些依賴天然蛋白-蛋白相互作用的“分子膠”�。通過(guò)AlphaFold-Multimer預(yù)測(cè)蛋白界面,再進(jìn)行分子對(duì)接��,模擬小分子作用于結(jié)合表面�。
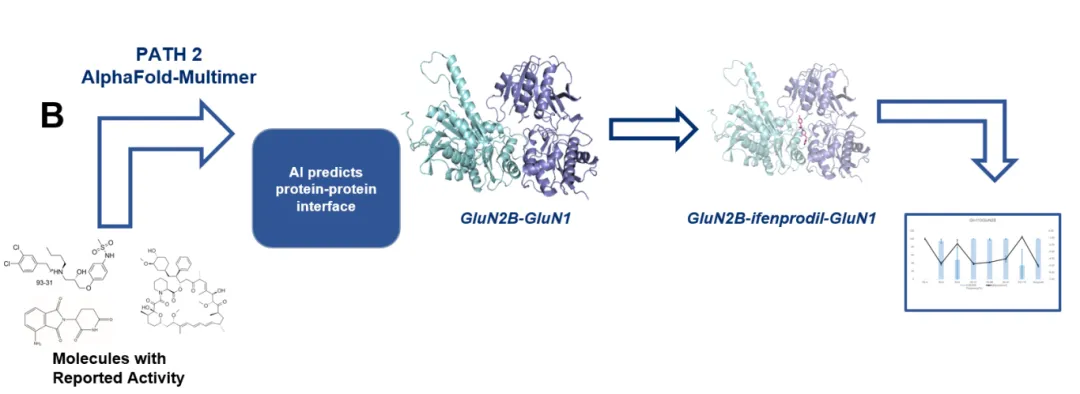
這兩種路徑構(gòu)成了完整的“分子膠”計(jì)算建模流程圖�,并結(jié)合實(shí)驗(yàn)晶體結(jié)構(gòu)驗(yàn)證模型準(zhǔn)確性,確保結(jié)果可靠���。
03 創(chuàng)新突破:從靜態(tài)結(jié)構(gòu)到動(dòng)態(tài)機(jī)制
本研究的另一大亮點(diǎn)是首次系統(tǒng)性地整合了人工智能(AI)建模與物理驅(qū)動(dòng)的分子動(dòng)力學(xué)模擬(MD Simulation),不僅重現(xiàn)了多個(gè)已知“分子膠”系統(tǒng)的晶體結(jié)構(gòu)�,還揭示了其在水環(huán)境中的動(dòng)態(tài)行為,包括:
水分子網(wǎng)絡(luò)的作用:某些“分子膠”依賴特定水橋穩(wěn)定蛋白互作;
pH依賴性機(jī)制:部分化合物通過(guò)質(zhì)子化狀態(tài)變化影響結(jié)合親和力�����;
構(gòu)象靈活性分析:捕捉蛋白-配體之間的動(dòng)態(tài)變化����,幫助優(yōu)化藥效與選擇性。
這些動(dòng)態(tài)信息對(duì)于理解“分子膠”的作用機(jī)制����、指導(dǎo)后續(xù)分子優(yōu)化具有重要意義。
04 案例解析:三大代表性系統(tǒng)驗(yàn)證模型有效性
研究團(tuán)隊(duì)選取了三個(gè)具有代表性的“分子膠”系統(tǒng)進(jìn)行深入分析:
1�、GluN2B-GluN1b系統(tǒng)
目標(biāo):開(kāi)發(fā)針對(duì)缺血性腦損傷的NMDA受體拮抗劑 ?
發(fā)現(xiàn):某些“分子膠”通過(guò)pH響應(yīng)機(jī)制,在酸性環(huán)境中表現(xiàn)出更強(qiáng)活性��,有助于精準(zhǔn)靶向炎癥區(qū)域����。同時(shí)通過(guò)構(gòu)效關(guān)系分析(SAR),提出了對(duì)NMDA靶向性提升的藥物設(shè)計(jì)新方向���。
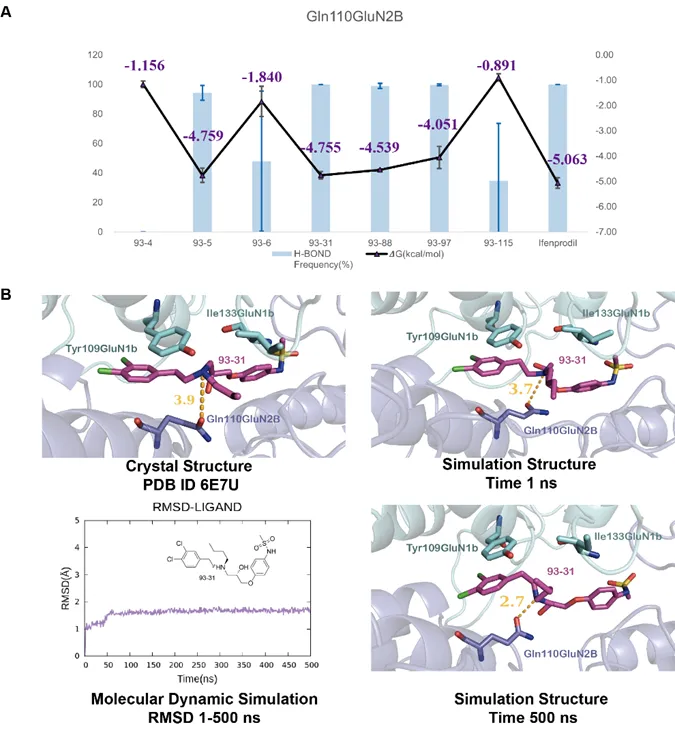
通過(guò)分子動(dòng)力學(xué)模擬揭示的93系列化合物的pH依賴性機(jī)制
2�����、FKBP12-Rapamycin-FRB系統(tǒng)
目標(biāo):mTOR通路抑制劑開(kāi)發(fā) ?
揭示:解釋了Rapamycin作為分子膠在FKBP12和FRB系統(tǒng)中的構(gòu)效關(guān)系����,分析出具有基石作用的化學(xué)基團(tuán),同時(shí)提出了Rapamycin衍生物設(shè)計(jì)的新方向�。
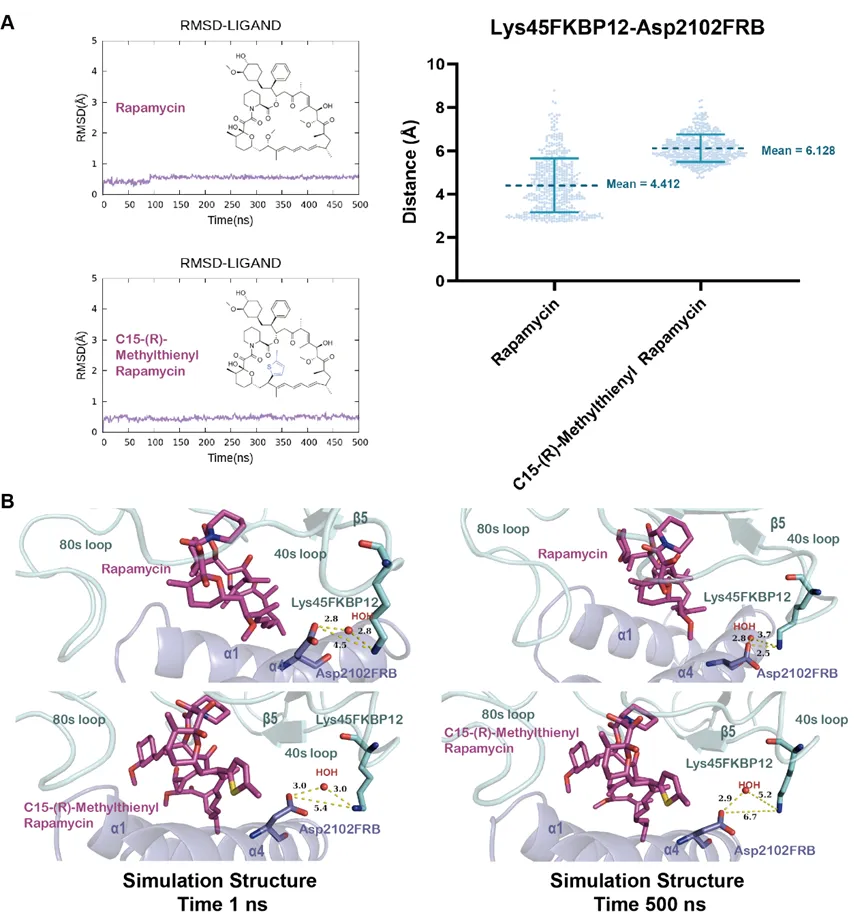
分子動(dòng)力學(xué)模擬闡述雷帕霉素結(jié)合機(jī)制
3��、CRBN-IMID-IKZF系統(tǒng)
目標(biāo):開(kāi)發(fā)選擇性降解轉(zhuǎn)錄因子的“分子膠”
成果:成功解釋了DKY709為何能選擇性降解IKZF2而非IKZF1���,揭示了CRBN與IKZF之間的關(guān)鍵相互作用��。
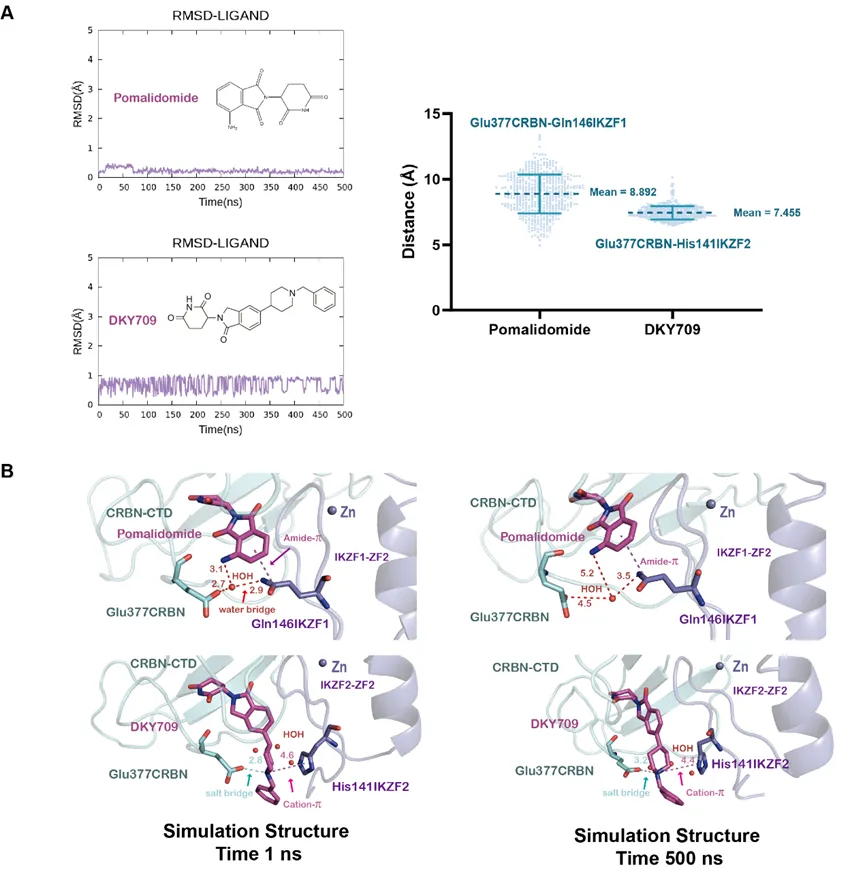
分子動(dòng)力學(xué)模擬闡明Pomalidomide和DKY709的選擇性機(jī)制
05 未來(lái)展望:推動(dòng)“分子膠”進(jìn)入理性設(shè)計(jì)時(shí)代
盡管“分子膠”領(lǐng)域近年來(lái)發(fā)展迅猛��,但目前仍處于早期探索階段���。本文提出的基于AI的結(jié)構(gòu)預(yù)測(cè)+水分子網(wǎng)絡(luò)分析+分子動(dòng)力學(xué)模擬的綜合策略���,為未來(lái)的“分子膠”藥物發(fā)現(xiàn)提供了可復(fù)制、可擴(kuò)展的研究范式����。
隨著更多結(jié)構(gòu)數(shù)據(jù)的積累和AI算法的不斷進(jìn)化,我們有理由相信�����,“分子膠”將成為繼PROTAC之后又一顛覆性蛋白靶向治療平臺(tái)����,在癌癥、自身免疫���、神經(jīng)系統(tǒng)疾病等多個(gè)重大疾病領(lǐng)域帶來(lái)革命性突破�����。
論文鏈接 :https://doi.org/10.1021/acs.jcim.5c00387
蘇州予路乾行生物科技有限公司(Divamics Inc.)打造了獨(dú)特的多尺度分子動(dòng)力學(xué)模擬平臺(tái)與創(chuàng)新藥早研決策AI平臺(tái)��,旨在更精準(zhǔn)理解藥物分子與靶點(diǎn)的動(dòng)態(tài)相互作用和作用機(jī)制��,理性設(shè)計(jì)藥物�����,預(yù)測(cè)藥效和成藥性��,突破傳統(tǒng)藥物發(fā)現(xiàn)瓶頸��,為小分子�、多肽、大分子等多種類型的藥物研發(fā)提供Hits-to-PCC一體化研發(fā)平臺(tái)��。 公司獲評(píng)蘇州市工業(yè)園區(qū)科技領(lǐng)軍項(xiàng)目�、蘇州市級(jí)姑蘇領(lǐng)軍人才項(xiàng)目、國(guó)家高新技術(shù)企業(yè)�����,核心技術(shù)獲得諾貝爾化學(xué)獎(jiǎng)得主Roald Hoffmann教授推薦����。公司總部位于蘇州�,在北京設(shè)有計(jì)算中心���,在新加坡���、日本設(shè)有BD合作中心����,目前已與超50家國(guó)內(nèi)外生物醫(yī)藥企業(yè)合作推進(jìn)70余條新藥研發(fā)管線。